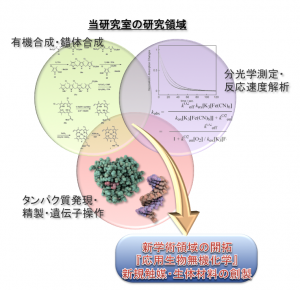
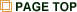研究内容
(研究対象)ポルフィリン、ヘム、金属タンパク質、酸化・還元酵素、超分子バイオナノ構造体
(研究方法)有機合成、錯体合成、タンパク質発現・精製、遺伝子操作、生体分子修飾、生体類似分子構築、反応追跡、構造解析、分光学測定、反応機構解析、物性評価、触媒活性評価
有機化学・錯体化学・生化学を融合させた「応用生物無機化学」の開拓をめざして
 我々の研究グループではこれまで、主にポルフィリン鉄錯体を補欠因子として有するヘムタンパク質に着目し、その基本的メカニズムを解明するとともに、構造的・反応論的知見を基盤とした「ヘムタンパク質のバイオエンジニアリング」を実施してきました。生体内に数多く存在するヘムタンパク質は、電子移動、酸素貯蔵・運搬、ガスセンサー、触媒反応等に関与する重要なタンパク質群であり、従来の遺伝子学的手法による変異体作成と並んで、補欠因子の化学修飾が重要な研究アプローチです。そこで、補欠因子の基本構造であるポルフィリンおよびその類縁体の化学的特性に注目し、ヘムタンパク質の天然ヘムを我々が独自にデザイン・合成した人工ヘムと置換した再構成タンパク質を調製し、その機能を明らかにするとともに、天然を凌駕する新しい機能性タンパク質の創製に挑戦しています。
我々の研究グループではこれまで、主にポルフィリン鉄錯体を補欠因子として有するヘムタンパク質に着目し、その基本的メカニズムを解明するとともに、構造的・反応論的知見を基盤とした「ヘムタンパク質のバイオエンジニアリング」を実施してきました。生体内に数多く存在するヘムタンパク質は、電子移動、酸素貯蔵・運搬、ガスセンサー、触媒反応等に関与する重要なタンパク質群であり、従来の遺伝子学的手法による変異体作成と並んで、補欠因子の化学修飾が重要な研究アプローチです。そこで、補欠因子の基本構造であるポルフィリンおよびその類縁体の化学的特性に注目し、ヘムタンパク質の天然ヘムを我々が独自にデザイン・合成した人工ヘムと置換した再構成タンパク質を調製し、その機能を明らかにするとともに、天然を凌駕する新しい機能性タンパク質の創製に挑戦しています。さらに、近年、ノンヘムタンパク質の機能変換や、非天然の金属クラスター含有タンパク質、有機金属含有タンパク質合成などにも取り組み、高性能の生体類似触媒の開発に着手しています。また、機能性ナノマテリアルの構築をめざした超分子タンパク質ポリマー(タンパク質をモノマーとするタンパク質自己組織化集合体)の構築や、金属界面との複合化を実施しています。
以上のように、補欠因子の分子設計および合成を行い、得られた金属錯体をタンパク質と融合させる研究手法を用い、我々は、主に、有機合成化学の力量・錯体化学の知識・生化学の技能を基盤とした次世代の研究領域としての「応用生物無機化学」の開拓をめざしています。
ヘムタンパク質の機能変換・機能解明
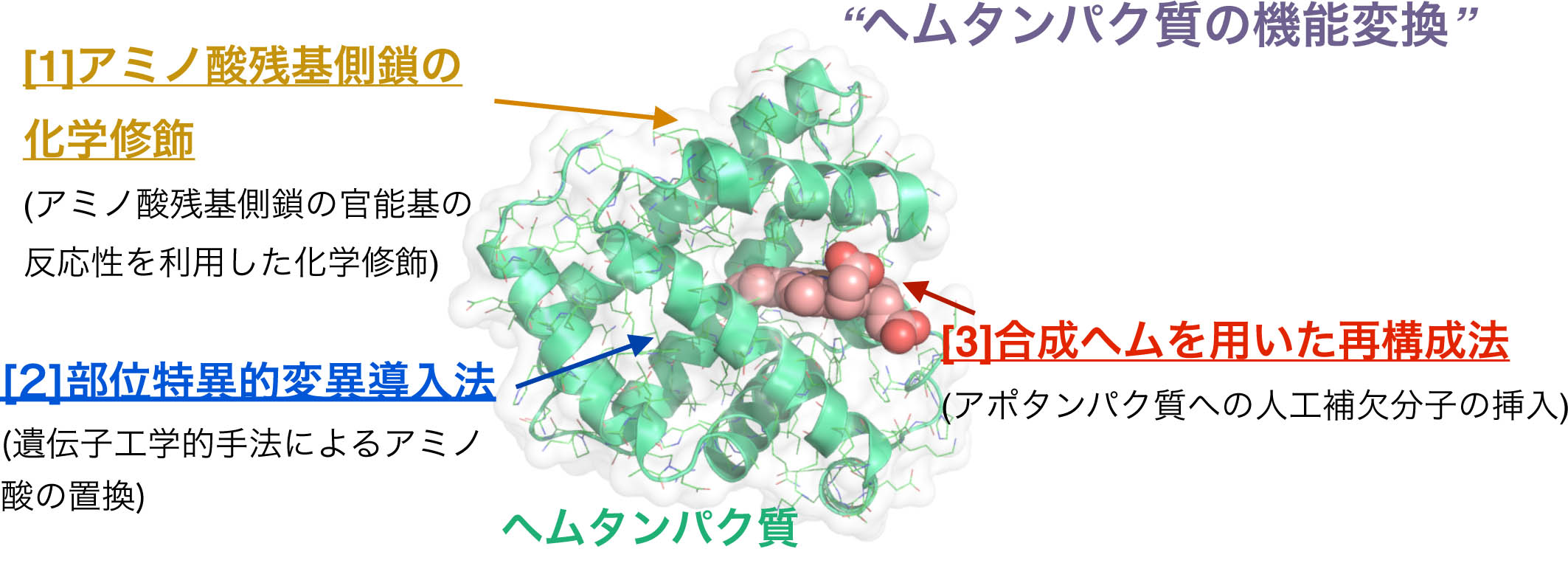
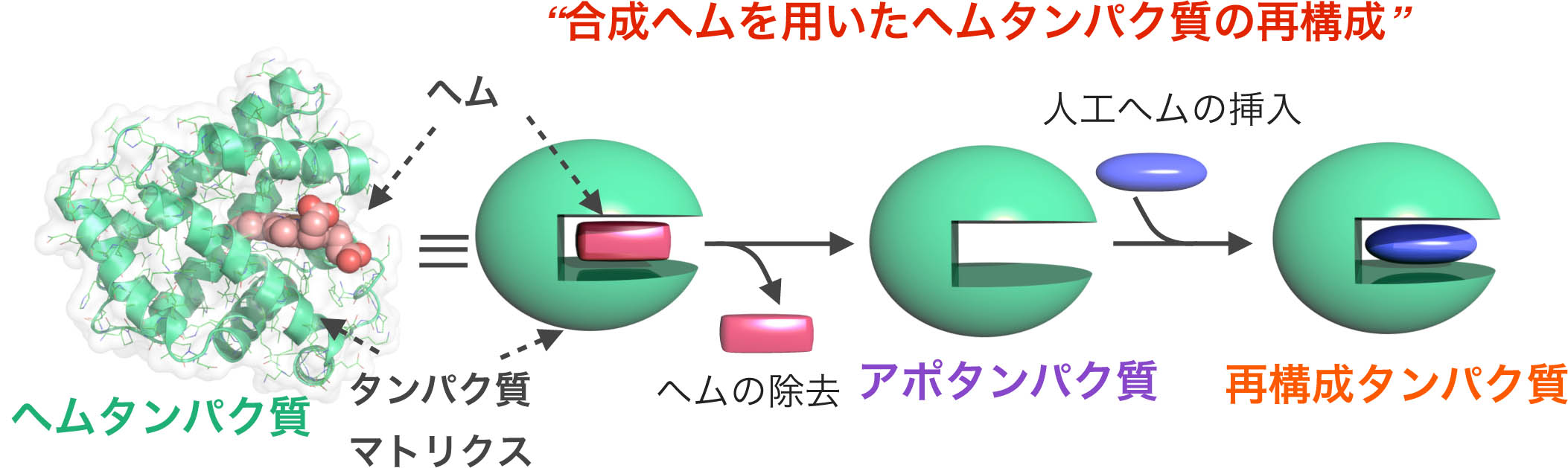
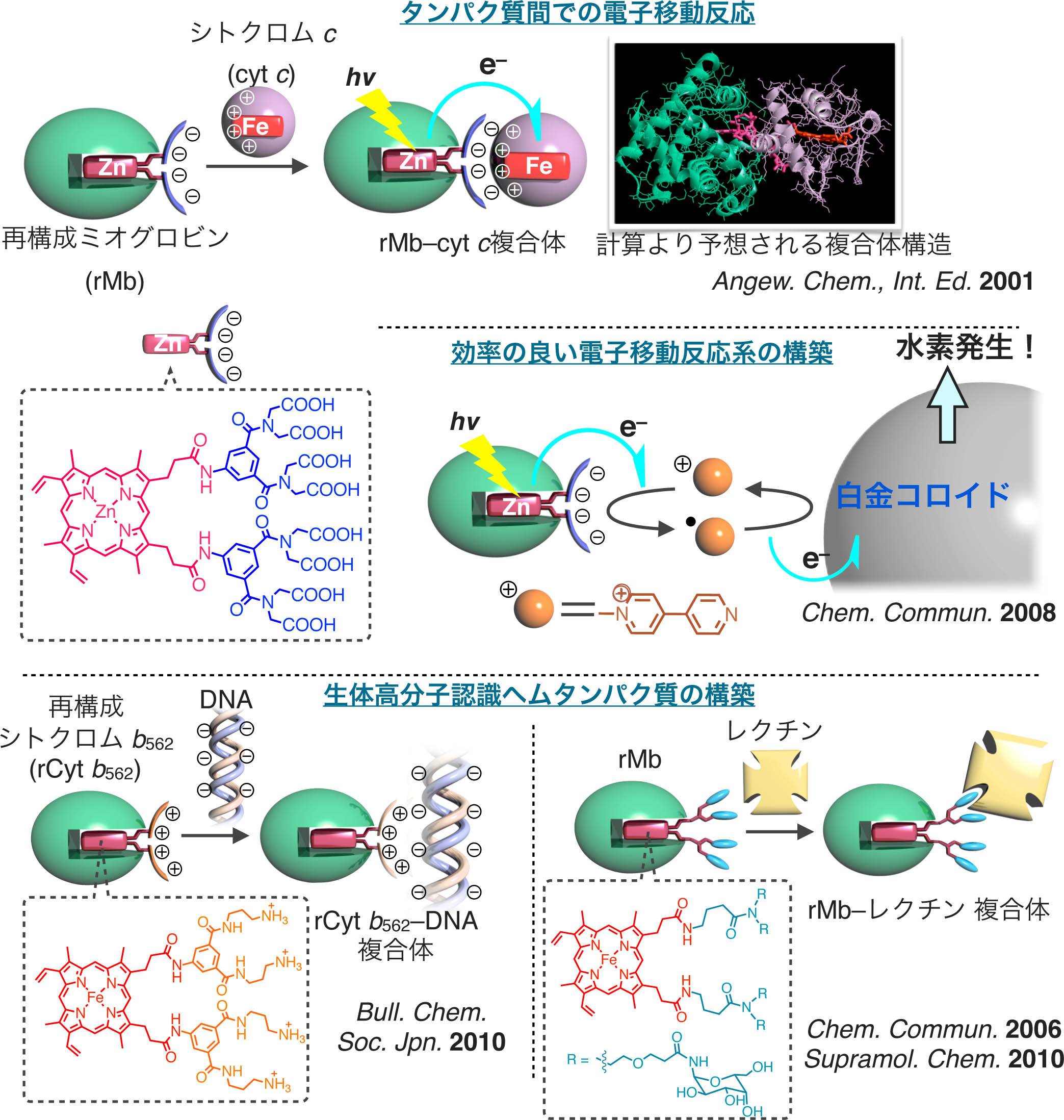
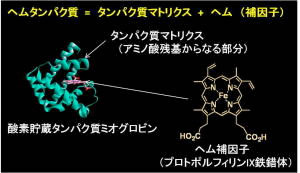 生体内に存在するミオグロビンやヘモグロビン、西洋わさびペルオキシダーゼ、シトクロムP450などは、機能は異なるものの、共通の補欠因子であるヘムb(プロトポルフィリンIX鉄錯体)を持っています。従って、分子設計を基に合成された「合成ヘム」を用いたヘムタンパク質の「再構成法」が可能であり、アミノ酸置換による遺伝子学的手法やアミノ酸残基側鎖の化学修飾とは別のアプローチで機能変換することができます。我々は、この再構成法を利用して、さまざまな「合成ヘム」を有機合成・錯体合成により構築し、ヘムタンパク質への導入を達成しています。本手法により、例えば、酸素貯蔵機能を持つミオグロビンの機能向上、酸化触媒酵素や電子移動反応を担うタンパク質への機能変換、再構成ミオグロビンによる内分泌攪乱化学物質の効率的分解が可能であることを明らかにしています。また、補欠因子置換は、遺伝子学的変異体作成と並んで、タンパク質機能そのものを解明する方法としても有用であることを示し、ミオグロビンだけでなく、ヘムタンパク質全体に研究対象を広げています。
生体内に存在するミオグロビンやヘモグロビン、西洋わさびペルオキシダーゼ、シトクロムP450などは、機能は異なるものの、共通の補欠因子であるヘムb(プロトポルフィリンIX鉄錯体)を持っています。従って、分子設計を基に合成された「合成ヘム」を用いたヘムタンパク質の「再構成法」が可能であり、アミノ酸置換による遺伝子学的手法やアミノ酸残基側鎖の化学修飾とは別のアプローチで機能変換することができます。我々は、この再構成法を利用して、さまざまな「合成ヘム」を有機合成・錯体合成により構築し、ヘムタンパク質への導入を達成しています。本手法により、例えば、酸素貯蔵機能を持つミオグロビンの機能向上、酸化触媒酵素や電子移動反応を担うタンパク質への機能変換、再構成ミオグロビンによる内分泌攪乱化学物質の効率的分解が可能であることを明らかにしています。また、補欠因子置換は、遺伝子学的変異体作成と並んで、タンパク質機能そのものを解明する方法としても有用であることを示し、ミオグロビンだけでなく、ヘムタンパク質全体に研究対象を広げています。1) J. Am. Chem. Soc., 121, 7747–7750 (1999).
2) Acc. Chem. Res., 35, 35–43 (2002).
3) J. Am. Chem. Soc., 124, 11226–11227 (2002).
4) J. Am. Chem. Soc., 124, 11234–11235 (2002).
5) J. Am. Chem. Soc., 126, 436–437 (2004).
6) J. Am. Chem. Soc., 126, 16007–16017 (2004).
7) J. Am. Chem. Soc., 127, 56–57 (2005).
8) Inorg. Chem., 44, 9391–9396 (2005).
9 ) Inorg. Chem., 45, 10530–10536 (2006).
10) J. Am. Chem. Soc., 129, 12906–12907 (2007).
11) J. Am. Chem. Soc., 131, 15124–15125 (2009).
12) Chem. Asian J., 6, 2491–2499 (2011).
13) J. Am. Chem. Soc., 135, 17282–17285 (2013).
14) Chem. Commun., 50, 12560–12563 (2014).
再構成法による生体分子相互作用インターフェイスの導入
15) Chem. Soc. Rev., 126, 355–364 (1997).
16) J. Am. Chem. Soc., 120, 4910–4915 (1998).
17) Angew. Chem., Int. Ed., 113, 1132–1135 (2001).
18) Chem. Commun., 29, 3131–3133 (2006).
19) Chem. Commun., 31, 3684–3686 (2008).
20) Bull. Chem. Soc. Jpn., 4, 375–377 (2010).
21) Supramol. Chem., 22, 57–64 (2010).
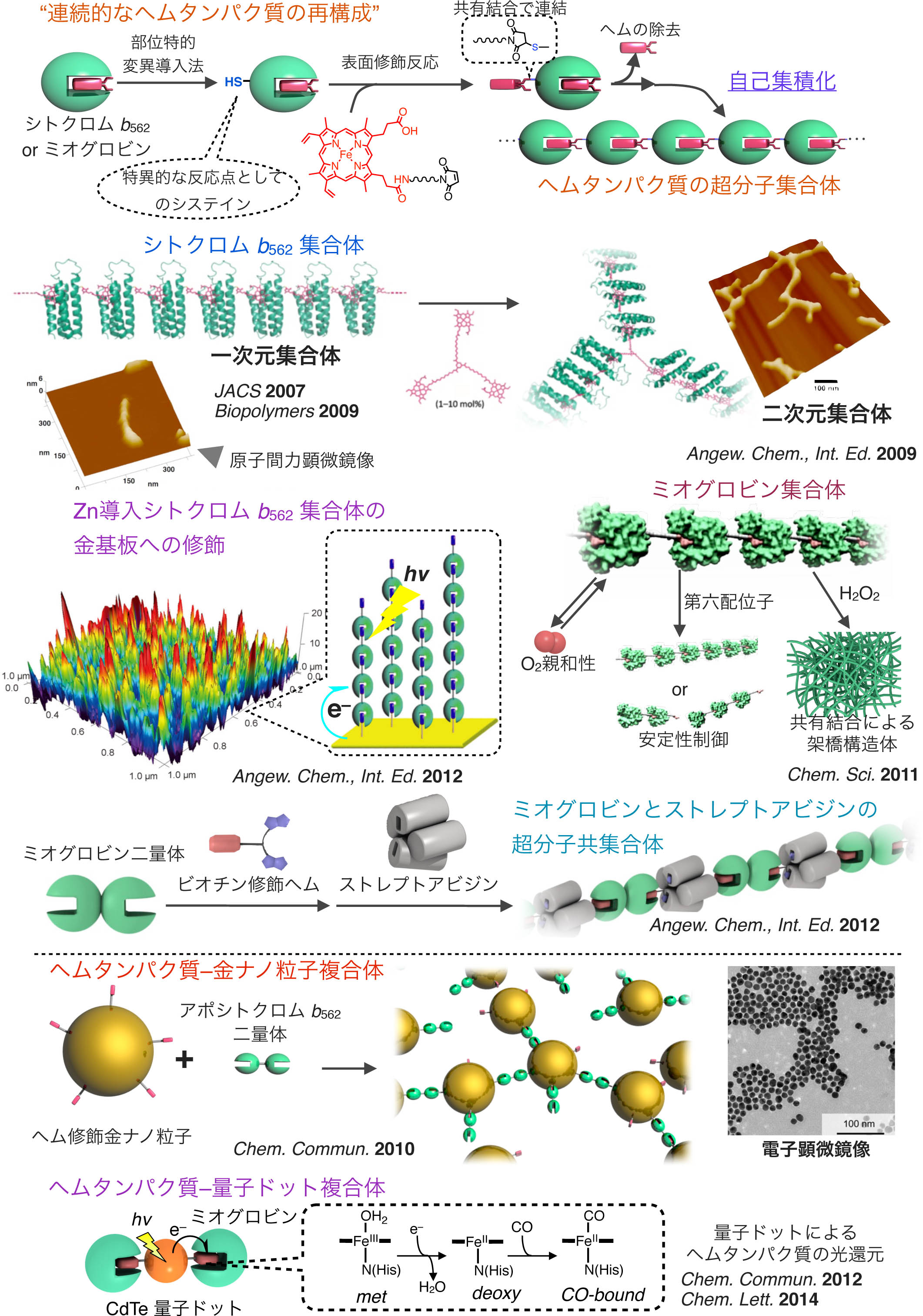
ヘムタンパク質の超分子集合体と金ナノ粒子複合体
22) Chem. Commun., 48, 11714–11726 (2012). Feature Article
23) J. Am. Chem. Soc., 129, 10326–10327 (2007).
24) Biopolymers, 3, 194–200, (2009). Front Cover
25) Angew. Chem., Int. Ed., 48, 1271–1274 (2009). Inside Front Cover
26) Chem. Commun., 9107–9109 (2010). Front Cover
27) Chem. Sci., 2, 1033–1038 (2011). Backside Cover
28) Angew. Chem., Int. Ed., 512628–2631 (2012). Hot Article
29) Angew. Chem., Int. Ed., 51, 3818–3821 (2012). Front Cover
30) Chem. Commun., 48, 8054–8056 (2012). Inside Front Cover
31) Chem. Biodivers., 9, 1684–1692 (2012).
32) J. Inorg. Organomet. Polym. Mat., 23, 172–179 (2013).
33) Dalton Trans., 42, 16102–16107 (2013).
34) Chem. Lett., 43, 1152–1154 (2014).
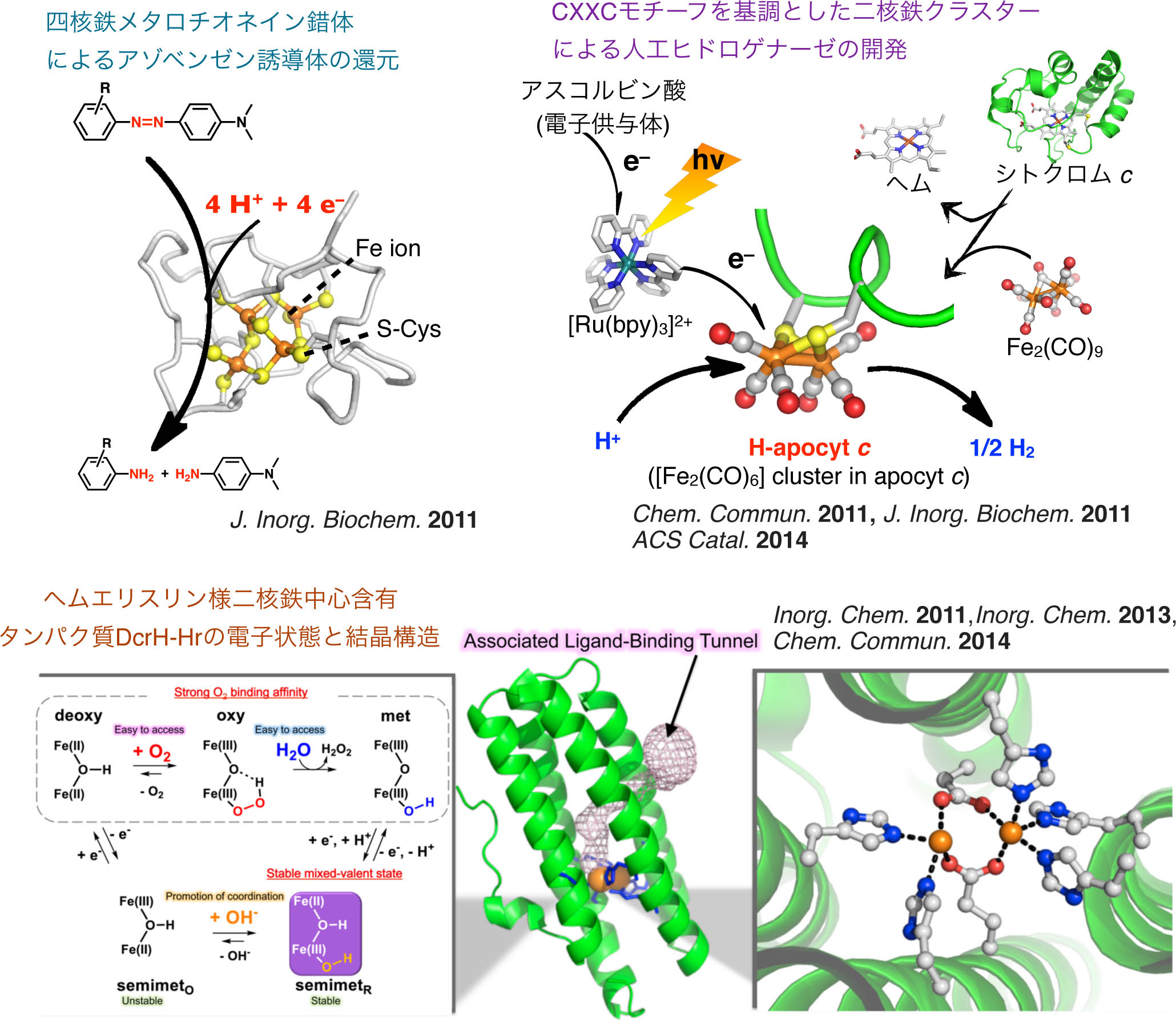
タンパク質内での二核/複核金属クラスターの構築と評価
35) J. Inorg. Biochem., 702–708 (2011).
36) Chem. Commun., 8229–8231 (2011). Inside Front cover
37) Inorg. Chem., 50, 4892–4899 (2011).
38) J. Inorg. Biochem.,108 159–162 (2012).
39) Inorg. Chem., 52, 13014–13020 (2013).
40) Chem Commun., 50, 3421–3423 (2014). Front Cover.
41) ACS Catal., 4, 2645–2648 (2014).
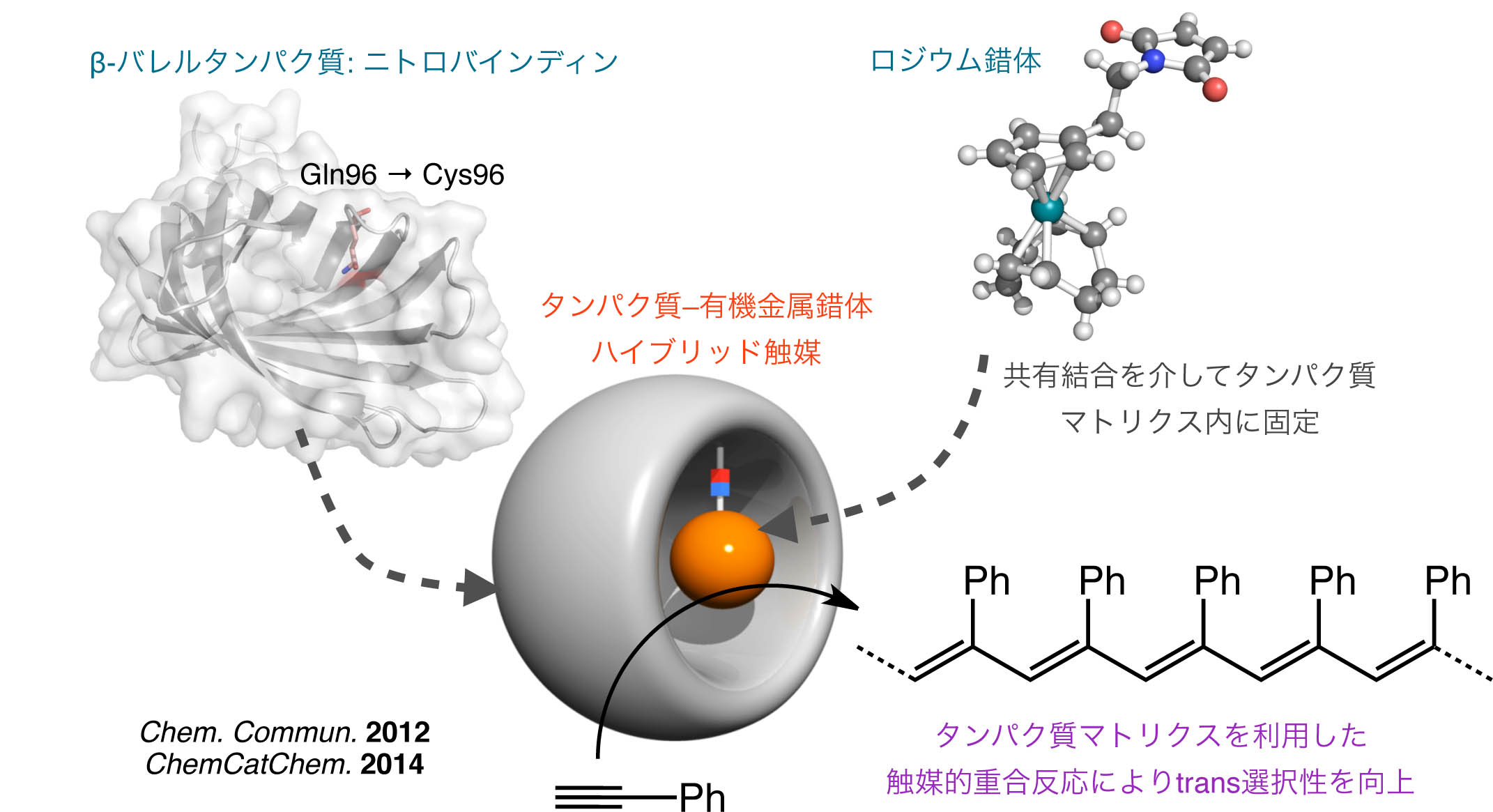
有機金属錯体とタンパク質を用いた新規生体触媒の開発
天然金属酵素におけるタンパク質マトリクスは、触媒反応に置いて活性中心となる金属や基質と相互作用し、高い活性や生成物の立体制御を実現しています。 これらに倣って、天然では行なわれていない触媒反応を天然酵素と同様にタンパク質マトリクスで自在に制御できれば、物質変換や機能性分子生成の魅力的な手法となります。 我々の研究室では、それらの反応を触媒する有機金属錯体に着目し、タンパク質マトリクス内に導入して、新規ハイブリッド生体触媒による立体選択的な反応や高触媒活性の実現をめざしています。 実際に、剛直なβ-バレル構造を有するニトロバインディンに、C-C結合形成重合反応を触媒するRh錯体を共有結合的に導入し、フェニルアセチレンの重合反応におけるtrans選択性を向上させています。
42) Chem. Commun., 48, 9756–9758 (2012).
43) ChemCatChem, 6, 1229–1235 (2014). Front Cover.
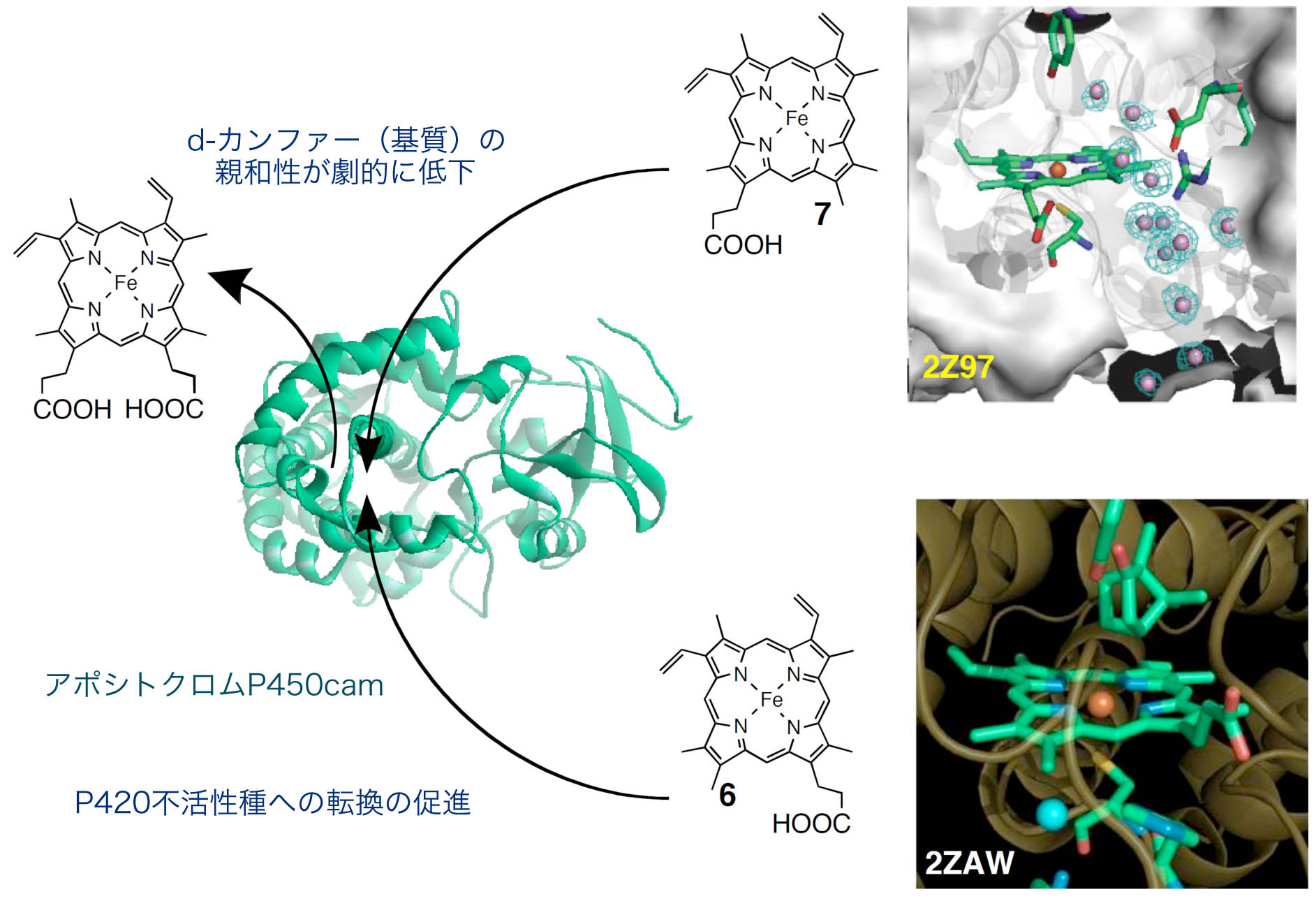
ヘムタンパク質におけるヘムプロピオン酸側鎖の機能的役割解明
44) Biochemistry, 46, 9406–9416 (2007).
45) J. Am. Chem. Soc., 130, 432–433 (2008).
46) J. Am. Chem. Soc., 131, 1398–1400 (2009).
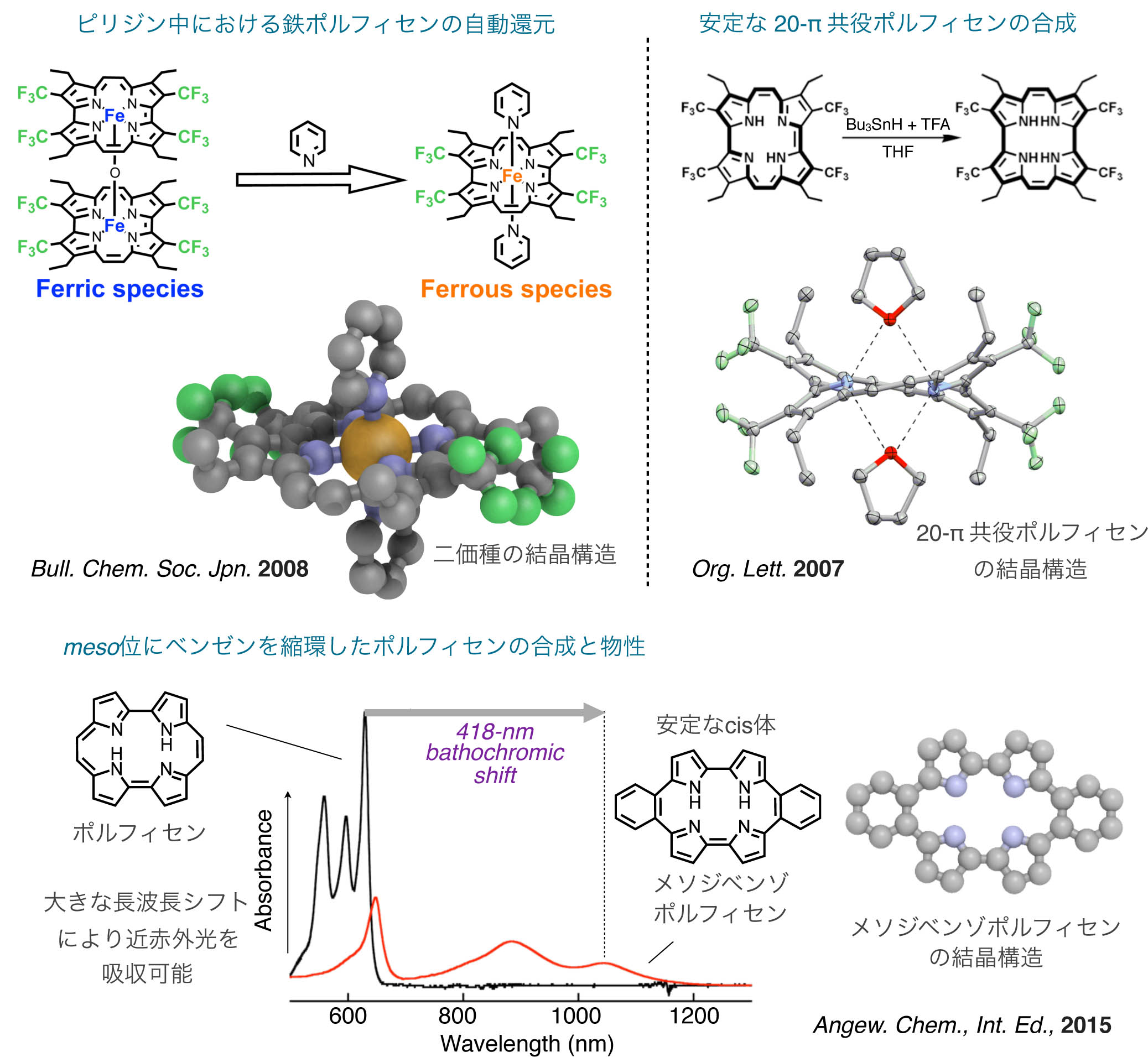
ユニークなポルフィリノイドの化学
47) Org. Lett., 5, 2845–2848 (2003).
48) Inorg. Chem., 42, 7345–7347 (2003).
49) Org. Lett., 9, 5303–5306 (2007).
50) Bull. Chem. Soc. Jpn., 81, 76–83 (2008). BCSJ Award
51) Organometallics, 30, 1869–1873 (2011).
52) J. Porphyrins Phthalocyanines, 16, 616–625 (2012).
53) J. Org. Chem., 77, 8946–8955 (2012).
54) Angew. Chem., Int. Ed., in press (2015).